AI新藥登上Nature子刊:46天合成新藥候選分子,比傳統(tǒng)方法快15倍
用AI進(jìn)行藥物開發(fā),可以省下2至3年的研發(fā)時(shí)間。
銅靈 發(fā)自 凹非寺
量子位 出品 | 公眾號(hào) QbitAI
用AI進(jìn)行藥物開發(fā),可以省下2至3年的研發(fā)時(shí)間。
最新一期的Nature子刊上,就刊登了這樣一項(xiàng)新研究。
這項(xiàng)來自Insilico Medicine和藥明康德等機(jī)構(gòu)的AI算法,21天內(nèi)就能夠設(shè)計(jì)出潛在分子架構(gòu),并在46天內(nèi)完成初步生物學(xué)驗(yàn)證。
也就是說,單從研發(fā)過程來看,AI 46天設(shè)計(jì)系統(tǒng),距離真正可用的藥物問世,只有臨床驗(yàn)證這臨門一腳。
據(jù)《連線》報(bào)道,這種新方法比傳統(tǒng)制藥公司的研發(fā)過程快15倍。
藥明康德做了一筆計(jì)算,這個(gè)系統(tǒng)能省下數(shù)月到數(shù)年的研發(fā)時(shí)間,省下幾十億美元的高昂研發(fā)開支。
省時(shí)省力還省錢,自然也就獲得了更多認(rèn)可。
哈佛大學(xué)的系統(tǒng)生物學(xué)家Mohammed AlQuraishi評(píng)價(jià)說,這項(xiàng)工作向前邁出了一大步,表明其AI可以定制,不僅能與特定目標(biāo)結(jié)合,而且能造出在細(xì)胞和動(dòng)物體內(nèi)表現(xiàn)良好的分子。
這是制藥公司希望看到的,論文一作Alex Zhavoronkov 說。
目前,這個(gè)登上Nature子刊的研究也開源了。
DDR1為目標(biāo)靶點(diǎn)
在論文Deep learning enables rapid identification of potent DDR1 kinase inhibitors中,研究人員詳細(xì)描述了整個(gè)實(shí)驗(yàn)過程。
研究人員將DDR1設(shè)為目標(biāo)靶點(diǎn)。
據(jù)合肥物質(zhì)科學(xué)研究院此前資料顯示,這是一種與細(xì)胞增殖、分化、粘附、遷移和侵襲等多種細(xì)胞功能有關(guān)的受體酪氨酸激酶。
此前研究顯示,DDR1激酶的過度表達(dá)和功能獲得性突變可增加腫瘤模型動(dòng)物的致瘤性,而敲除DDR1激酶的基因會(huì)抑制腫瘤的發(fā)生和轉(zhuǎn)移,因此,DDR1激酶很有可能是一個(gè)抗癌癥藥物開發(fā)的靶點(diǎn)。
為了找出DDR1激酶抑制劑,研究人員開發(fā)了新的AI模型,GENTRL(generative tensorial reinforcement learning,生成張量強(qiáng)化學(xué)習(xí)模型)。
△?GENTRL模型架構(gòu)圖(圖片來自Nature官網(wǎng))
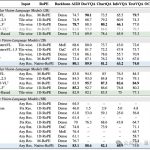
研究人員選擇了6個(gè)不同數(shù)據(jù)集訓(xùn)練模型,6個(gè)數(shù)據(jù)集各有側(cè)重,包含已確定的DDR1激酶抑制劑和3D結(jié)構(gòu),激酶抑制劑的常見分子結(jié)構(gòu)、無靶向激酶分子結(jié)構(gòu)等。
研究人員用數(shù)據(jù)集,用強(qiáng)化學(xué)習(xí)的方法訓(xùn)練模型后,初步得到近30000個(gè)不同的DDR1激酶抑制劑結(jié)構(gòu)。
從確定靶點(diǎn)到篩選出最具潛力結(jié)構(gòu)的整個(gè)過程,研究人員只用了21天。
這只是初步的篩選結(jié)果,隨后,研究人員從中隨機(jī)挑選40種結(jié)構(gòu),進(jìn)行RMSD化學(xué)空間分布檢測(cè)。
結(jié)果顯示,其中的39個(gè)都是此前的專利或者研究中沒有提到的全新結(jié)構(gòu)。
他們又挑出了六種結(jié)構(gòu),進(jìn)行生物體外和體內(nèi)的進(jìn)一步實(shí)驗(yàn)。體外實(shí)驗(yàn)結(jié)果顯示,4種結(jié)構(gòu)在初始測(cè)試中顯示出成為藥物的潛質(zhì),2種結(jié)構(gòu)對(duì)DDR1有很高的抑制性,且能降低與纖維化進(jìn)程有關(guān)的標(biāo)志物。
在動(dòng)物身上進(jìn)行實(shí)驗(yàn)后(沒錯(cuò),躺槍的還是小白鼠),研究人員證明了篩選出的DDR1激酶抑制劑分子對(duì)目標(biāo)蛋白質(zhì)都有效,藥代動(dòng)力學(xué)特征良好,初步生物學(xué)驗(yàn)證通過。
從確定靶點(diǎn)到通過初步生物學(xué)驗(yàn)證,GENTRL模型只用了46天的時(shí)間,就完成了傳統(tǒng)方法數(shù)月到數(shù)年的研究。
不過,Zhavoronkov表示,GENTRL生成的藥物還需要進(jìn)行臨床實(shí)驗(yàn),距離真正以一種新型藥物的姿態(tài)問世,還需要幾年時(shí)間。
AI大法好
AI在生物化學(xué)領(lǐng)域,早就已經(jīng)嶄露頭角了。
DeepMind去年公布了生物學(xué)界的AlphaGo——AlphaFold,只要知道蛋白質(zhì)的氨基酸序列,就可以預(yù)測(cè)蛋白質(zhì)分子的三維折疊結(jié)構(gòu)。
它僅僅基于蛋白質(zhì)的基因序列,就能預(yù)測(cè)蛋白質(zhì)的3D結(jié)構(gòu),而且結(jié)果比以前的任何模型都要精確。
在“蛋白質(zhì)結(jié)構(gòu)預(yù)測(cè)奧運(yùn)會(huì)”CASP比賽中,力壓其他97個(gè)參賽者。《衛(wèi)報(bào)》報(bào)道稱,AlphaFold預(yù)測(cè)出了43種蛋白質(zhì)中25種蛋白質(zhì)的最精確結(jié)構(gòu)。
今年,MIT把AI的預(yù)測(cè)能力又推進(jìn)了一步,直接通過氨基酸序列預(yù)測(cè)蛋白質(zhì)分子的生物學(xué)功能,跳過AlphaFold預(yù)測(cè)蛋白質(zhì)立體結(jié)構(gòu)的步驟。
對(duì)于某個(gè)氨基酸序列,該模型將為3D結(jié)構(gòu)中的每個(gè)氨基酸位置產(chǎn)生一個(gè)嵌入表示。機(jī)器學(xué)習(xí)模型根據(jù)這些嵌入,基于接觸圖準(zhǔn)確預(yù)測(cè)每個(gè)氨基酸的功能。
研究人員使用該模型預(yù)測(cè)哪些蛋白質(zhì)可以通過細(xì)胞膜,所得結(jié)果的準(zhǔn)確性已經(jīng)超過之前最先進(jìn)的模型。
格拉斯哥大學(xué)的研究人員訓(xùn)練出了一個(gè)人工智能驅(qū)動(dòng)的有機(jī)化學(xué)合成機(jī)器人,這套機(jī)器人系統(tǒng)包含一系列泵和反應(yīng)器,并與質(zhì)譜儀、核磁共振光譜儀及紅外光譜儀等儀器連接到一起,使探索大量化學(xué)反應(yīng)的過程實(shí)現(xiàn)自動(dòng)化。
傳送門
Nature論文地址:
https://www.nature.com/articles/s41587-019-0224-x#Ack1
GitHub地址:
https://github.com/insilicomedicine/gentrl
— 完 —
誠(chéng)摯招聘
量子位正在招募編輯/記者,工作地點(diǎn)在北京中關(guān)村。期待有才氣、有熱情的同學(xué)加入我們!相關(guān)細(xì)節(jié),請(qǐng)?jiān)诹孔游还娞?hào)(QbitAI)對(duì)話界面,回復(fù)“招聘”兩個(gè)字。
量子位 QbitAI · 頭條號(hào)簽約作者
?’?’ ? 追蹤AI技術(shù)和產(chǎn)品新動(dòng)態(tài)
- 微軟公布19財(cái)年財(cái)報(bào):凈利潤(rùn)增長(zhǎng)22%,云計(jì)算首超個(gè)人計(jì)算業(yè)務(wù)2019-07-19
- 騰訊云推出物聯(lián)網(wǎng)邊緣計(jì)算平臺(tái),具備五大特點(diǎn),想攻克物聯(lián)網(wǎng)落地難題2019-08-28
- DeepMind醫(yī)療業(yè)務(wù)幾經(jīng)動(dòng)蕩,現(xiàn)在團(tuán)隊(duì)并入Google2019-09-20
- 首例基因編輯干細(xì)胞治療艾滋病:北大鄧宏魁參與,達(dá)最佳治療效果2019-09-14




意-902307139285942360.jpeg)