如何殺死癌細(xì)胞?斯坦福醫(yī)學(xué)院:騙它開啟自毀
治療癌癥的思路已轉(zhuǎn)變
將兩種蛋白質(zhì)黏合在一起,就能誘導(dǎo)癌細(xì)胞“自殺”了?!
一覺醒來,Hacker News上迅速刮起了一股討論之風(fēng):
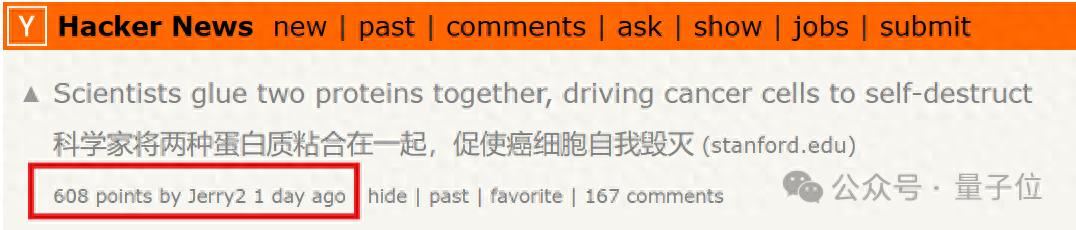
事情是醬紫的,這是一項來自斯坦福醫(yī)學(xué)院的研究:
他們開發(fā)了一種新型分子(藍(lán)色和黃色),該分子將兩種蛋白質(zhì)(紫色和紅色)連接起來,然后啪的一下,兩種蛋白質(zhì)共同激活了癌細(xì)胞中的自我毀滅基因。
該研究共同一作Roman Sarott博士表示:
自從發(fā)現(xiàn)了癌基因以來,人們一直在嘗試將其”關(guān)閉”以治療癌癥。
相反,我們正在嘗試?yán)盟鼈儊砑せ钚盘杺鲗?dǎo)。
換句話說,治療癌癥的思路,從“抑制”轉(zhuǎn)向了“誘導(dǎo)癌細(xì)胞自殺”。
對此,Hacker News網(wǎng)友贊道:
我認(rèn)為這項研究真的很酷,很有新意。

事實上,這項研究的靈感誕生于一位教授疫情期間的一次散步——
誘騙癌細(xì)胞自行消亡
一次,當(dāng)Gerald Crabtree教授在加州一處森林散步時,縈繞他腦海的是20世紀(jì)70年代的一項里程碑式發(fā)現(xiàn):
細(xì)胞為了生物體的更大利益而觸發(fā)自身的死亡。
1972年,澳大利亞病理學(xué)家John Kerr等人首次提出了細(xì)胞凋亡(apoptosis)的概念,并描述了其形態(tài)學(xué)特征。
當(dāng)時他們認(rèn)為凋亡不同于壞死,它是一種正常的自殺性死亡程序。
后來的研究陸續(xù)表明,細(xì)胞凋亡實際上對許多生物過程至關(guān)重要,包括所有器官的正常發(fā)育以及我們免疫系統(tǒng)的精細(xì)調(diào)節(jié)。
這一機(jī)制保留了識別病原體的細(xì)胞,但殺死識別自身的細(xì)胞,從而防止自身免疫病。
是不是有點不好理解?
舉個例子,免疫系統(tǒng)負(fù)責(zé)識別和攻擊外來的病原體,比如病毒和細(xì)菌,但有時候免疫系統(tǒng)會錯誤地產(chǎn)生一些能夠識別并攻擊自身組織的細(xì)胞。
一旦這些細(xì)胞不受控制,就會導(dǎo)致自身免疫病,即身體錯誤地攻擊自己的組織和器官。
而細(xì)胞凋亡機(jī)制好比一個安全系統(tǒng),它能夠識別并清除那些可能對自己造成傷害的 “叛徒” 細(xì)胞。

受此啟發(fā),研究的另一作者David Korn教授也直呼:
這就是我們想要治療癌癥的方式,消滅600億個細(xì)胞(人體每天會自然消亡600億個細(xì)胞,主要是血液和腸道細(xì)胞)而不傷害任何旁觀者(指正常細(xì)胞)
要知道,傳統(tǒng)的癌癥治療方法(如化療和放療),往往會對身體的健康細(xì)胞造成破壞,導(dǎo)致副作用,而利用細(xì)胞自我凋亡的特性有望避免這一負(fù)面影響。
說干就干,研究團(tuán)隊后來開發(fā)了一種新型分子,它能將兩種蛋白質(zhì)結(jié)合起來,利用新生成的蛋白質(zhì)復(fù)合物激活細(xì)胞內(nèi)部的自毀機(jī)制。
具體而言,他們以其中一種蛋白質(zhì)——BCL6作為研究對象。
通常來說,如果BCL6發(fā)生突變,它會引發(fā)一種被稱為彌漫大B細(xì)胞淋巴瘤的血液癌癥。
在淋巴瘤中,突變的BCL6位于DNA上,其位置非常微妙——
它離細(xì)胞凋亡基因很近,但又阻止細(xì)胞自我凋亡,以至于成為癌細(xì)胞“不死不滅”的幫兇。
對此,新的分子策略登場了。(發(fā)表在今年10月《科學(xué)》上)
將CDK9蛋白激酶抑制劑與BCL6配體相結(jié)合,引導(dǎo)CDK9和BCL6在靶基因位點靠近。
這種策略導(dǎo)致CDK9從抑制劑復(fù)合物中釋放,進(jìn)而磷酸化RNA聚合酶II并增強(qiáng)轉(zhuǎn)錄延伸。
在老鼠實驗中,這一過程針對性地影響了BCL6異常反應(yīng)的B細(xì)胞,而不改變CDK9的整體活性。
說人話就是,該分子將BCL6和CDK9這兩種蛋白質(zhì)連接起來,以此開啟BCL6通常抑制的凋亡基因。

對此,研究人員還打了個形象比喻:
你拿走癌癥生存所依賴的東西,然后反轉(zhuǎn)劇情,讓它成為殺死癌癥的東西。

在實驗中,當(dāng)對彌漫大B細(xì)胞淋巴瘤細(xì)胞進(jìn)行分子測試時,他們發(fā)現(xiàn)該分子確實可以殺死癌細(xì)胞。
與此同時,在對健康小鼠進(jìn)行測試后,他們發(fā)現(xiàn)這種分子即使摧毀了小鼠體內(nèi)的一類特定的健康B細(xì)胞(這類細(xì)胞也依賴于BCL6蛋白),也沒有產(chǎn)生明顯的毒性副作用。
目前,研究人員正在對患有彌漫大細(xì)胞B細(xì)胞淋巴瘤的小鼠進(jìn)行測試,以評估這種化合物在活體中殺死癌癥的能力。
不過令人遺憾的是,研究人員在對859種不同的癌細(xì)胞進(jìn)行測試后發(fā)現(xiàn):
這種新的分子只能殺死彌漫大細(xì)胞B細(xì)胞淋巴瘤細(xì)胞,而對其他類型的癌細(xì)胞無效。
網(wǎng)友:一切都需要時間
基于上述進(jìn)展,兩位教授Nathanael Gray和Gerald Crabtree(均為斯坦福癌癥研究所成員)?還一起創(chuàng)業(yè)了。
2023年,他們共同成立了一家生物技術(shù)初創(chuàng)公司——Shenandoah Therapeutics,專攻癌癥治療。
公司目標(biāo)是,進(jìn)一步測試這種分子以及之前開發(fā)的類似分子,以期收集足夠的臨床前數(shù)據(jù),從而支持這些化合物的臨床試驗。
當(dāng)然,他們還計劃構(gòu)建類似分子,以針對其他驅(qū)動癌癥的蛋白質(zhì)(比如作為多種癌癥驅(qū)動因素的癌基因Ras)。
不過,有身為同領(lǐng)域的網(wǎng)友表示,從實驗到臨床還是太需要時間了,掰指頭一數(shù):
了解細(xì)胞中每種蛋白質(zhì)的功能需要時間(我們?nèi)匀粚Υ蠖鄶?shù)蛋白質(zhì)不太了解);
發(fā)現(xiàn)各種癌癥如何利用細(xì)胞中的蛋白質(zhì)機(jī)制以謀取自身利益也需要時間(新方法至今仍在被發(fā)現(xiàn));
思考分子膠并將其變?yōu)閷嵱靡残枰獣r間;
構(gòu)建合適的化學(xué)物質(zhì)并進(jìn)行測試同樣需要時間(即使你知道了所有前面的步驟,這也需要時間);
……

嗯,師傅莫念了~至少還有希望?

- 10億美元OpenAI股權(quán)兌換迪士尼版權(quán)!米老鼠救Sora來了2025-12-12
- 跳過“逐字生成”!螞蟻集團(tuán)趙俊博:擴(kuò)散模型讓我們能直接修改Token | MEET20262025-12-12
- 梁文鋒,Nature全球年度十大科學(xué)人物!2025-12-09
- 英偉達(dá)巧用8B模型秒掉GPT-5,開源了2025-12-06